En éste contenido se describirá
características y propiedades de la materia. Se desarrolla el modelo cinético –
corpuscular para comprender las características de los estados de la materia,
el comportamiento de los gases y para explicar lo que ocurre durante los
cambios de estado.
Contenido
digital
·
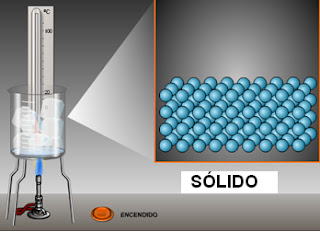
Los estados de la materia:
La materia puede presentarse en distintos
estados. Los más comunes son: sólido, líquido y gaseoso. Cada uno posee
características y propiedades que lo identifican. Algunas de esas
características pueden detectarse mediante los sentidos.
Para ello podrás observar el siguiente
vídeo:
Luego visitá el siguiente link y resolvé
las actividades finales que te propone
·
Propiedades de los gases:
Como en el estado gaseoso las fuerzas de
atracción entre las partículas son casi inexistentes, éstas pueden moverse en
todas las direcciones y alejarse entre sí lo máximo posible. Por este motivo,
la materia en estado gaseoso no tiene ni forma ni volumen propios, se la puede
expandir o comprimir fácilmente, y tiene muy baja densidad.
La presión de los gases está relacionada
con la intensidad con que las partículas chocan contra las paredes del
recipiente que los contenga. A mayor cantidad de choques, mayor es la presión
del gas.
La temperatura se relaciona con la energía
cinética de las partículas del gas, que depende de su velocidad. Cuanto más
rápido se mueven, mayor es la energía cinética y por lo tanto, mayor es la
temperatura.
Ingresá a la siguiente página del sitio
EDUCAPLUS: http://www.educaplus.org/gases/index.html
Desplázate hacia abajo hasta “LABORATORIO”
leé las instrucciones y entra en la sala de BOYLE y a la sala de CHARLES.
Realizá las experiencias, observá los
gráficos que se forman y compará con los gráficos que se presenta en tu libro.
Por ejemplo: